
About Us
はじめに In the Beginning
プラズマ化学生物学研究所(PCBL)のホームページへようこそ
弊法人は、低温大気圧/コールドプラズマ(室温、大気圧下で生成するプラズマ)の特異的な
抗がん作用の基礎研究と応用を目的に設立されました。 低温大気圧プラズマは、試験管や
動物体内で様々ながん細胞の増殖を阻害し、細胞死を誘発する一方、正常細胞にはほとんど
傷害を与えません。 このがん細胞だけを傷害するという性質を利用すれば、有効で、副作用の
少ない理想的ながん治療を実現できるかもしれないという大いなる期待を抱かせたからでした。
しかし、この7年間の研究の結果は、このような作用がコールドプラズマという物理現象
そのものよりもそれが産生する活性酸素がもたらす細胞内の酸化ストレスによることを
明らかにしました。 さらに私たちは、この酸化ストレスの標的のひとつがミトコンドリアの動態
(形態ならびに細胞内分布)であることを見出し、ミトコンドリア酸化ストレスをコールドプラズマよりも簡便かつ強力に起こさせる物理化学的方策の開発に成功しました。
現在、この技術の基礎研究ならびに患者に優しいがん治療法を目指した開発を進めています。

鈴木・唐崎良弘代表理事の略歴
1955年東京生まれ。埼玉大学理学部化学科で有機化学を専攻。
東北大学大学院にて生化学を専攻。 民間会社、国立精神神経センター
研究員を経て、1988年より日本大学医学部で助教、講師、リサーチ
センターで研究グループリーダーとして研究・大学院教育に従事。 2017年一般社団法人プラズマ化学生物学研究所を設立し代表理事に就任現在に至る。 理化学研究所客員研究員、チェコ科学アカデミー、
イスラエル科学財団、オーストリア科学財団研究グラント審査員およびFrontiers in OncologyのGuest Editor 等を歴任。
2017年 6月から英国王立医学協会 (Royal Society of Medicine)会員。 Oncology Reports編集委員。 MagicBullet
ドイツ薬学会パウルエーリッヒノーベル賞受賞100周年記念国際
シンポジウム、中央ヨーロッパ肺癌学会など国際学会および
国内学会招請・招待講演多数。博士(医学)(Ph.D.)

What’s new
2018.4.1
代表理事が研究代表者の「Ca²⁺を標的とする骨肉腫の新規な治療法の基礎研究」が科研費基盤研究C(2018.4.1−2021.3.31)に採択されました。
いよいよ今日から新年度です。 本年度から鈴木真奈美研究員が新しいスタッフとして参加しました。また、日本大学医学部脳外科学助教の落合裕之博士が
非常勤研究員として悪性脳腫瘍グリオブラストーマのプラズマ照射液による治療法研究に参加されます。 新戦力の二人に期待します。
2021.4.1
研究代表者鈴木真奈美研究員の「プラズマ照射液を用いた治療抵抗性口腔癌の革新的治療法の創出」が科研費基盤研究C (2021.4.1−2024.3.31)
に採択されました。
2021.4.1
代表理事が研究代表者の「空気プラズマ照射液による骨軟部腫瘍の革新的治療法の創出」が科研費基盤研究C (2021.4.1−2024.3.31) に採択されました。
2021.10.1
東京計器(株)と共同でオゾン含有水溶液組成物をPCT出願しました。
2022.1.20
鈴木真奈美研究員らのプラズマ照射液の抗がん作用におけるMPMCの役割についての論文がInt J Mol Sciに掲載されました。
2023.4.1
落合祐之研究員が研究代表者である「ミトコンドリア動態を介するフェロトーシス制御による悪性神経膠腫治療の基礎研究」が科研費基盤C(2023.4.1−2026.3.31) に採択されました。
2023.8.3
鈴木真奈美研究員らのオゾン化メディウムの論文がEur J Cell Biol (ヨーロッパ細胞生物学雑誌) に電子掲載されました。
2023.9.21~23
落合祐之研究員が第82回日本癌学会学術集会(横浜)で低温大気圧プラズマによる膠芽腫の鉄依存性細胞死経路を介した抗がん作用について発表しました。
2023.10.10~12
共同研究者である熊本大学大学院生命科学研究部中山秀樹教授らと共同で第68回日本口腔外科学会総会·学術集会(大阪)において「空気プラズマによる
ミトコンドリアを標的とした口腔癌治療の基盤研究」について発表しました。
2023.10.11~13
鈴木真奈美研究員がWorld Mitochondria Society 主催14th World Congress on Targeting Mitochondria (ベルリン、ドイツ)
にオンライン参加してePoster発表しました。
2023.11.2~4
鈴木真奈美研究員と代表理事が26th International Symposium on Molecular Medicine(チボリ、ローマ、イタリア)に参加し、口頭発表と講演を行いました。
2024.5.18
落合祐之研究員らのNOによる膠芽腫と口腔癌に対するプラズマ照射液の作用制御の発見が Eur J Cell Biol に電子掲載されました。
2025.4.1
安藤隆研究員が研究代表者の「細胞死関連ミトコンドリアクラスター形成を標的とする骨肉腫がん幹細胞制御」研究が科研費基盤研究C (2025.4.1−2028.3.31)
に採択されました。
2025.4.1
科研費基盤研究Cの助成を受けて「プラズマ照射液の抗癌作用メカニズムの解析と臨床応用」(研究代表者熊本大学大学院生命科学研究部中山秀樹教授との共同研究、(2025.4.1−2028.3.31) がスタートしました。
2025.5.17
鈴木真奈美研究員が日本口腔科学会2025年度日本口腔科学会 Rising Scientist 賞を受賞しました。
2025.5.15~17
鈴木真奈美研究員と代表理事が第79回日本口腔科学会 (松本)に参加し、最新成果を同研究員が発表しました。
2025.7.16~19
熊本大学大学院生命科学研究部中山秀樹教授らと共同で 10th World Congress of the International Academy of Oral Oncology (IAOO)
(リバプール、英国) で空気プラズマ、オゾンによるミトコンドリア 動態制御を介した口腔癌治療について発表しました。
2025.10.1
弊法人は学校法人麻布獣医学園 ( 麻布大学 ) および 東京計器株式会社とオゾンならびに光活性化抗がん水溶液に関する共同研究に関する秘密保持契約を
締結しました。

Research
学際的がん治療研究
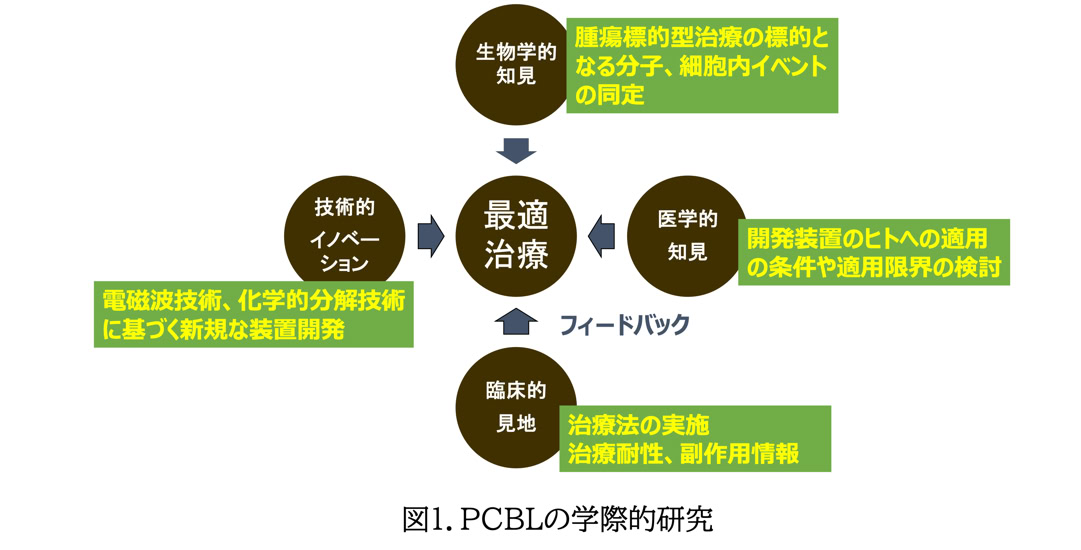
私たちは、医学者、臨床医や工学技術者など様々な分野の専門家と協力して学際的がん治療研究を推進しています(図1)。
この研究は、
1.有効で副作用の少ない治療の標的となりうる分子や細胞内イベントの生物学、化学的同定、
2.工学的治療技術のヒトへの適用に関する医学的知見の収集、
3.新規な電磁波ならびに化学的分解技術をベースとする装置開発、の密接な連携で構成されています。
さらに、開発した装置を実際に使用してその結果を新規な医療機器開発にフィードバックさせて、
現在の治療では治癒が困難である難治がんに対しても効果的で負担の少ない最適治療の実現を目指しています。
研究の出発点は、プラズマの抗がん作用
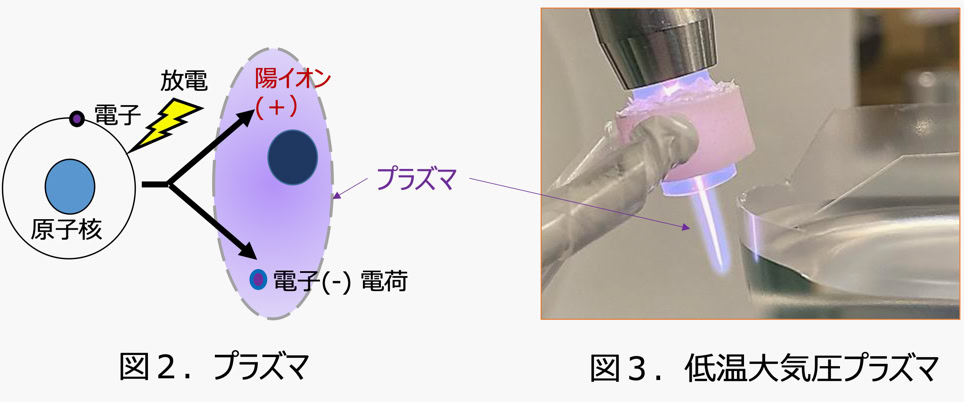
プラズマ (図2) とは部分的に電離 (原子が電子を放出してイオンとなること) したガスで、低温、大気圧条件で生成するものを
低温大気圧プラズマ ( Cold atmospheric plasma CAP )と呼びます(図3)。 CAPは、がん細胞を傷害するが、正常細胞には影響が
小さい腫瘍選択毒性を示すことがわかり、 近年副作用の少ないがん治療法候補として注目されています。
CAPを照射した液体( プラズマ照射液 )も同様な腫瘍選択毒性を発揮します。 CAPやプラズマ照射液がどのようにしてがん細胞だけを
傷害できるのかはまだよくわかっていませんが、スーパーオキシドなどの活性酸素や一酸化窒素などの活性窒素による酸化ストレスが
関与することは確かです。
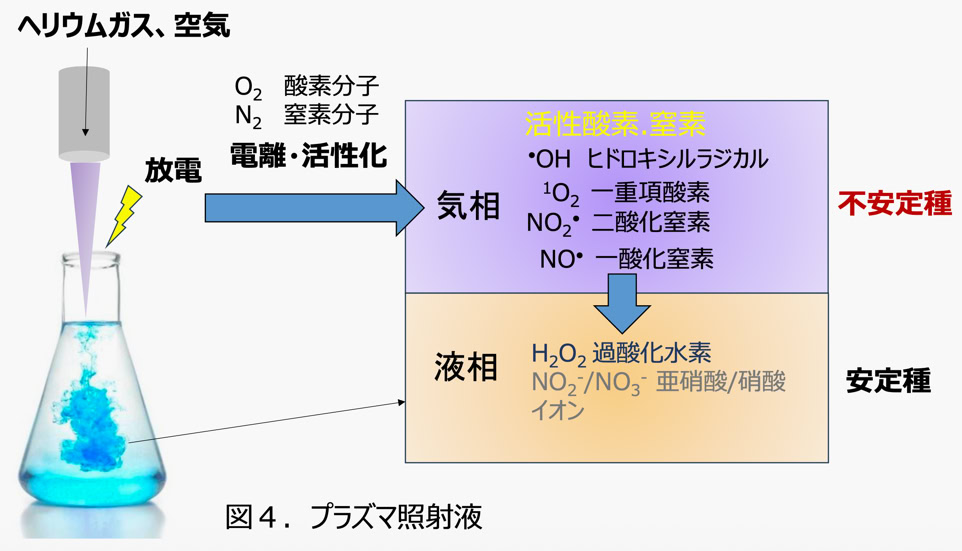
以下、プラズマ照射液の場合についてもう少し詳しく説明します。 CAPは高電圧による気体の放電で作製します。 この時周囲の空気に
含まれる酸素と窒素も電離、活性化されて、気相中に酸素分子よりも化学的に活性な化学種 ( 一重項酸素、ヒドロキシルラジカル、
一酸化窒素、 二酸化窒素) が生成されます。 しかし、これらはいずれも寿命が極めて短く、プラズマ照射液中 ( 液相 ) にはこれらの
分子群からできる、 より安定な過酸化水素や亜硝酸イオン、硝酸イオンが検出されます(図4)。
がん細胞は正常細胞よりも”サビ”やすい
これに対して、 プラズマ照射液はそれぞれのがんの正常細胞モデル ( がん細胞ではないが培養できる細胞を指す ) の増殖は抑制しないか
または促進しました。 アポトーシスは誘発されず、 細胞や細胞核の傷害も軽微でした。 さらに、細胞内の活性酸素も増加せず、
カルジオリピンの酸化 も見られませんでした。これらの結果から、 「がん細胞は正常細胞よりも何らかの理由で”サビ”やすい」 と考えられます。
考えられる理由のひとつは、酸化を防ぐ抗酸化系の低下です。 実際この考えはオゾン溶解液を用いた実験により確かめられました
(詳しくはこちらSuzuki-Karasaki et al., Eur J Cell Biol, 2023 )。
オゾン溶解液ー新たな抗がん性水溶液
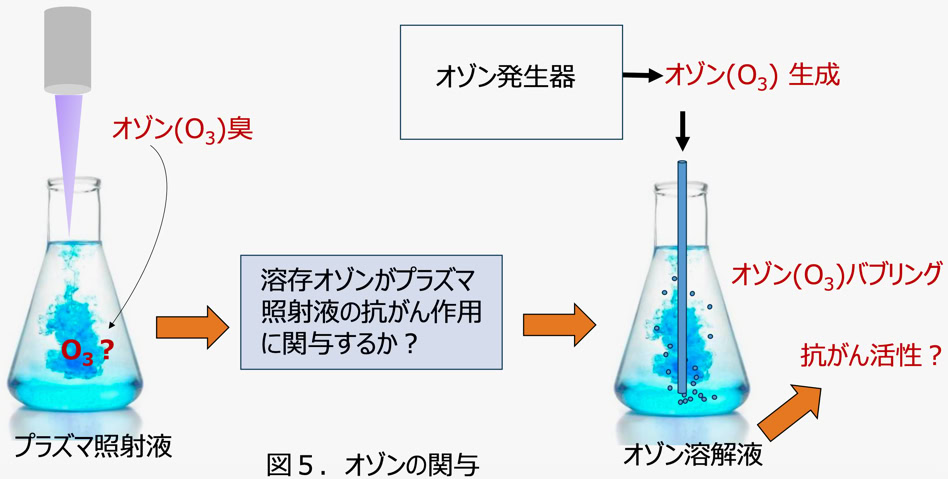
空気プラズマ照射液を作製する際に強いオゾン ( O₃ ) 臭があることから気相中にオゾンが生成することがわかりました。
オゾンは酸素原子3個からなる酸素の同位体で、 フッ素に次ぐ強い酸化力を持つ活性酸素のひとつです。 加水分解によって
ヒドロキシルラジカルや過酸化水素を生じます。 したがって、 もしかすると空気プラズマ照射液中にはオゾンが存在して抗がん作用に関与する
のではないかと考えられました。
この仮説を確かめるにはオゾン溶解液を作製して抗がん活性を調べる必要がありましたが、それには新規な実験機器が必要でした。
その理由は、 従来のオゾン作製法に問題があったからです。 オゾンは空気の放電で容易に産生されますが、 同時に窒素酸化物も生じます。
この窒素酸化物が空気プラズマ照射液中に亜硝酸イオン、 硝酸イオンとなって溶け込み、 プラズマ照射液の抗がん作用に影響を与えるおそれが
ありました。 そのため、 オゾン自体の抗がん作用を調べるには窒素酸化物を生成しないオゾン発生器が不可欠だったのです。
そこで、 精密機器メーカーの 東京計器 (株) と共同でそのような装置を開発しました。 開発された装置は純粋酸素( 99.9% )を誘電体バリア
放電によるプラズマで励起してオゾンを作製し、 液体中にバブリングさせるものです。 すべての工程が閉鎖系で行われて空気中の窒素が
混入しないので、 理論上オゾンだけが産生され、 窒素酸化物はできない仕組みになっています。
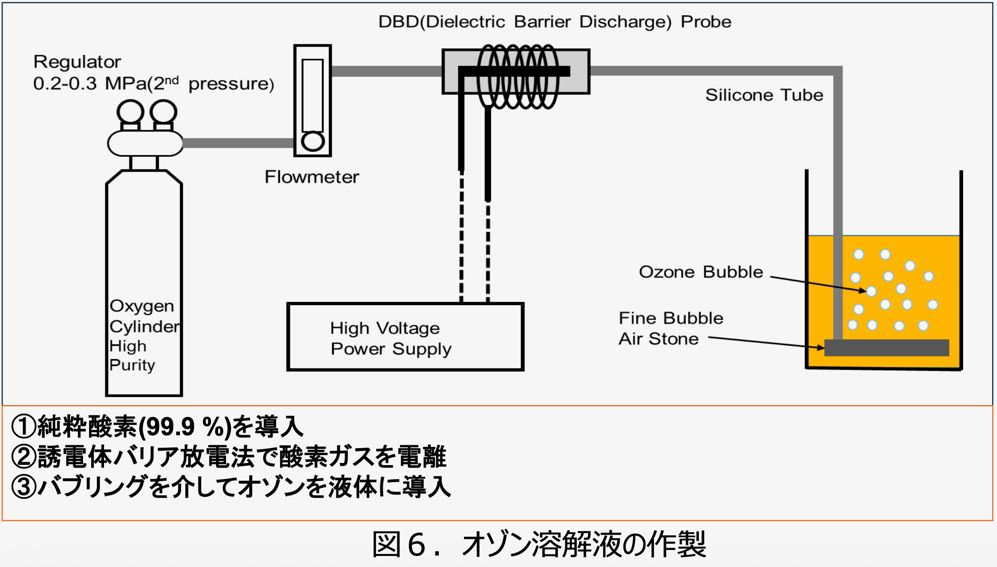
作製されたオゾン溶解液には、 オゾンの他に過酸化水素が検出されました。 これに対して、 予想どおり窒素酸化物は検出限界以下でした。
プラズマ照射液と同様にオゾン溶解液は骨肉腫、口腔癌細胞の増殖を抑制し、 細胞死を誘発しました。 さらにオゾン溶解液は、
悪性神経膠腫の中で最も悪性なグリオブラストーマ ( 膠芽腫 ) にも有効でした ( 詳しくはこちら ) Suzuki-Karasaki M et al.,
Eur J Cell Biol, 2023)。 グリオブラストーマは進行が非常に早く、 外科的手術、 化学療法や放射線による集学的治療にも抵抗性である
ために全生存期間はわずか14.6ヶ月に留まっており、 画期的な治療法が早急に求められているがんです。 このような成果からODMは新規な抗がん剤候補になると考えられたので、 これを特許出願中です ( 発明の名称: オゾン含有水溶液組成物 国際出願番号 : PCT/JP2022/039317)。
最近の研究により細胞が死滅するメカニズムはアポトーシスだけではなく、 オートファジー、 パラトーシス、 フェロトーシス、 パイロトーシス、パルタナトスなどの多くの別の経路 ( 総称して非アポトーシス細胞死と呼びます ) があることが明らかになりました。 興味深いことに
アポトーシス抵抗性のがん細胞もこれらの別の細胞死には感受性であることがわかってきました。 そのため、 非アポトーシス細胞死の活性化は新たながん治療標的として注目されています。 グリオブラストーマは非常にアポトーシス耐性なので、 オゾン溶解液はアポトーシスとは別の
細胞死を起こしている可能性がありました。 研究の結果、 複数の非アポトーシス細胞死が抗がん作用に関与することがわかり、 現在さらにそのメカニズムを詳しく調べています。
ミトコンドリア:細胞の生と死を調節する細胞小器官
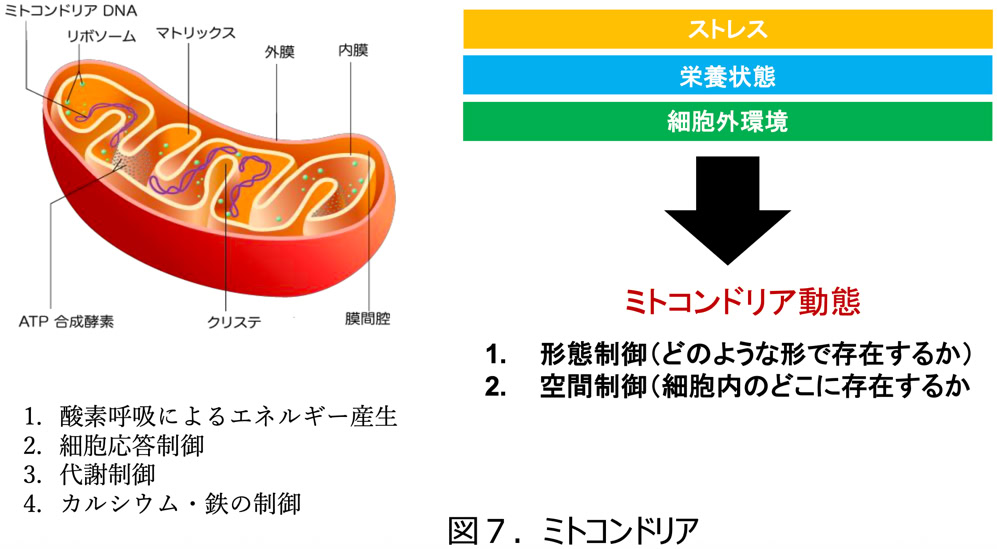
ミトコンドリア(図5)は、 細胞内の糸状構造として発見され、 1900年代初頭にドイツの C. Bendaによって糸球体 ( ギリシャ語のμιτοζ mitos 糸および κονδρον khondrion粒 に由来 ) と命名されました。 外膜と内膜の二重膜構造からなる細胞小器官
( オルガネラ )で、 エネルギー産生システム ( 電子伝達系、ATP合成酵素 ) を持ち、酸素呼吸 ( 好気的リン酸化 ) によるエネルギー( ATP )
産生の場であるので、 古くは細胞の “ 発電所 ” と呼ばれていました。 しかし現在では、 ミトコンドリアは細胞応答の調節、 代謝、 カルシウム、鉄の制御など非常に多様な機能を持つことがわかっています。 特に注目すべきは、 ミトコンドリアが、 細胞の生と死を司る正反対の機能を
持つ点です。 健常なミトコンドリアによるエネルギー産生は細胞の生存に不可欠ですが、 一旦、 ミトコンドリアが傷害されると逆に細胞の死を
招く物質が細胞内に放出されてしまうのです。
この細胞死を誘発する仕組みをうまく使えばがんの治療に利用できるのではないか、 こう考えて世界中で多くの科学者がミトコンドリアを
標的としたがん研究を行っています。 その中で私たちはミトコンドリアの動態に焦点を当てて研究を行っています。 ミトコンドリアの動態とは、「ミトコンドリアの形態」 と 「ミトコンドリアの細胞内分布」 を合わせた状態を指します。
がん細胞の“サビ”はミトコンドリア動態異常につながる
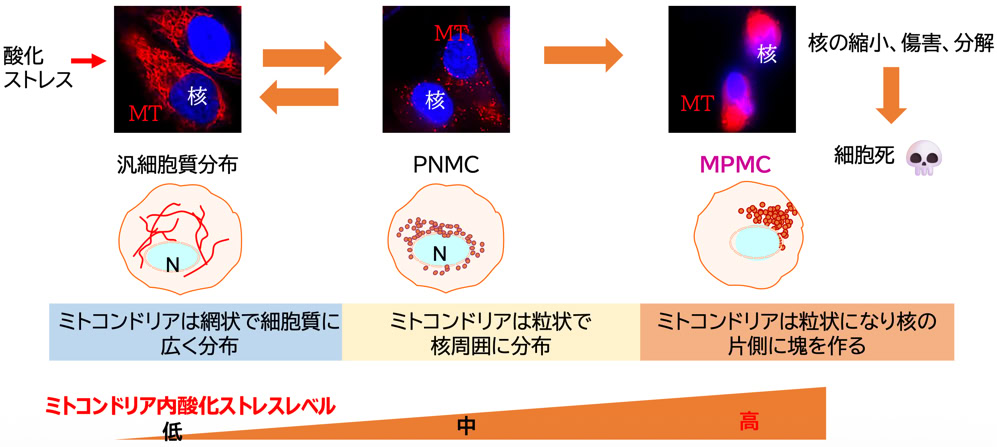
通常ミトコンドリアは網状構造を作って細胞質に広く分布しており、 これを汎細胞質分布と呼びます。 中程度 ( 細胞死は起きない ) の酸化ストレスが細胞に起きると、 ミトコンドリアはつながりを解消してバラバラに分かれて ( 分裂と呼びます ) 核周囲全体に分布します。 この
分布を PNMC ( Perinuclear mitochondrial clustering適当な和名はありません ) といいます。 私たちは、 世界に先駆けてプラズマ
照射液やオゾン溶解液がこれらの分布様式とは異なるミトコンドリアの分布を引き起こすことを発見しました。 ミトコンドリアは分裂した後に、 核の片側の周縁部近傍に塊を作り、 これががん細胞の死滅につながることを明らかにしました ( 詳しくはこちら Suzuki-Karasaki et al., IntJ MolSci, 2022; Eur J Cell Biol, 2023)。 そこで 、 この現象を単極性ミトコンドリア核辺縁部クラスター 成 ( Monopolar perinuclear mitochondrial clustering, MPMC ) と命名しました。 これまでがん細胞では中程度の酸化ストレスがPNMCを起こしてがん細胞を低酸素から保護することが知られていましたが、 MPMCは細胞死に関与するミトコンドリアの分布の初めての例となります。
プラズマ照射液の抗がん作用には活性酸素や活性窒素が重要な役割を果たすことが知られていましたが、 私たちは、 MPMCには活性酸素や
活性窒素が必要なことを突き止めました ( 詳しくはこちら Suzuki-Karasaki et al., IntJMolSci, 2022; Eur J Cell Biol , 2023)。
これに対して、 細胞死が起こらない正常細胞ではミトコンドリアは分裂するに留まり、 MPMCは形成されないことからMPMCが細胞死に
必要なことがわかりました。
図8.ミトコンドリア(MT)分布
Members
プラズマやオゾンのその先へ
プラズマ照射液やオゾン溶解液はいずれもがん細胞を優先的に傷害して正常細胞に対する影響は小さいので、 有効で安全な治療を提供
できることが期待されます。 しかし、 実用化には問題が残されています。 空気プラズマ照射液は比較的簡単に作れますが、 前述のように
オゾンが周囲に発生します。 高濃度オゾンは人体に大変有害なので取扱いに注意が必要になります。 オゾン溶解液の製造装置はオゾンの
危険性に対処するための安全設計が必要なので、 コンパクトにするのが困難です。
さらに、どちらの液体も速やかに活性が失われるので、低温保存しても長期の使用が困難です。 これらの短所のない抗がん水溶液を作る
にはプラズマやオゾンを使用しない方法が必要です。 さらに、 できればベッドサイドで作製できるようになれば、 活性の低下を心配しないで
薬剤を直ちに投与できます。 そこで、私たちは電磁波技術の専門家と一緒にこの問題の解決に取り組んでいます。 また、 口腔癌のような患部が見えるがんの場合はがんの外から酸化ストレスをかけてがんを治療することも可能と思われます。 現在、特殊な化学物質をがんに蓄積させ、レーザーを当ててがん細胞の中に活性酸素を生成させ死滅させるという光力学療法が行われていますが、 私たちはレーザーを使わず、
また特別な化合物も必要としない方法の開発に成功しました ( 特許出願準備中 )。
今後、臨床適用のための研究を臨床家の皆さんとともに進めていきます。
代表理事・研究員
理事・研究員
理事
理事
監事
研究員
研究員
研究員
研究員
鈴木良弘 Ph.D., RSM 博士(医学)
安藤隆 MD, Ph.D., 博士(医学)
岡嶋 洋
印南静加
田渕徹(田渕行政書士事務所)
落合豊子 MD, Ph.D., 博士(医学)
鈴木真奈美、Ph.D., 博士(医学)
鈴木美喜
落合祐之 MD, Ph.D., 博士(医学)

Achievements
最近の業績 Achievements: Papers, Conference Presentations, Awards, Patents
研究論文 Research Papers
学会発表 Conference Presentations
受賞 Awards
知的財産権 Patents

Access
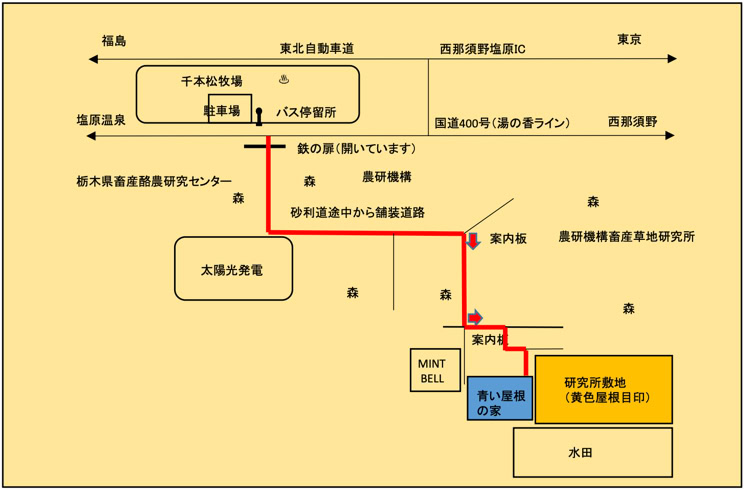
一般社団法人プラズマ化学生物学研究所
住所 〒329-2813
栃木県那須塩原市高阿津398-4
Tel: 0287-35-3276
090-2756-3207 (代表理事携帯)
Homepage: https//pcbl.jp
E-mail: [email protected] (代表理事)
自動車でお越しの場合
浦和ICー西那須野塩原IC 150 km 1時間 30分
那須塩原ICー研究所 約10分
電車でお越しの場合
東京駅ー那須塩原駅 (東北新幹線)70分
那須塩原駅ー研究所 約25分
Plasma ChemiBio Laboratory © 2025 - All Rights Reserved